Hirnmetastasen
25. Februar 2015
Singuläre oder solitäre Hirnmetastasen sollten bei günstiger prognostischer Konstellation operativ reseziert werden. Die Radiochirurgie ist eine sinnvolle Alternative zur Operation, sowohl bei radiosensitiven als auch radioresistenten Tumoren, und kann zur Rezidivbehandlung auch nach bereits erfolgter Strahlentherapie (Whole Brain Radiation Therapy [WBRT]) Ganzhirnbestrahlung) eingesetzt werden.
Inzidenz von Hirnmetastasen
Die häufigsten malignen Hirntumore sind nicht die primären, hirneigenen, sondern die Hirnmetastasen. Aus epidemiologischen Übersichtsarbeiten wurde eine jährliche Inzidenz von 8,3 bis 11 auf 100.000 Einwohner für die USA abgeleitet. Ausgangstumore nach Häufigkeit sind das Lungenkarzinom (45 bis 62 Prozent), gefolgt vom Mammakarzinom (20 bis 34 Prozent), dem malignen Melanom (5 bis 20 Prozent), dem Nierenzellkarzinom (5 bis 10 Prozent) und den kolorektalen Karzinomen (2 bis 4 Prozent). Bei 10 bis 20 Prozent aller Patienten ist bei Nachweis einer Hirnmetastasierung der Primarius unbekannt. Mit zunehmendem Alter steigt die Häufigkeit von Metastasen im zentralen Nervensystem. Intrazerebrale Metastasen siedeln sich vorwiegend in den Großhirnhemisphären (> 80 Prozent) und im Kleinhirn (15 Prozent), seltener im Hirnstamm oder in den Stammganglien an (5 Prozent). Spinale intramedulläre Metastasen, die fast ausschließlich im Endstadium metastatischer Tumorerkrankungen auftreten, stellen eine Rarität dar.
Liegen neben einer einzelnen Hirnmetastase weitere Metastasen außerhalb des ZNS vor, wird diese als singulär charakterisiert. Eine solitäre Metastase besteht, wenn keine weitere Organmanifestation außerhalb des ZNS existiert.
Die Entstehung von Hirnmetastasen
Inzwischen ist eine systemische Krebserkrankung immer besser therapeutisch kontrollierbar. Jedoch sind Hirnmetastasen infolge der Hirn-Blutschranke durch Chemotherapeutika nur eingeschränkt zugänglich. Das Gehirn wird somit als sicheres Rückzugsgebiet oder „sanctuary site“ für metastasierte Tumorzellen angesehen. Damit ist die steigende Inzidenz von Hirnmetastasen begründet.
Die Metastasierung ist ein Prozess der Disseminierung von Karzinomzellen aus einem Primärtumor mit Bildung eines Satellitengeschwulsts. Hierzu müssen Tumorzellen Eigenschaften entwickeln, die es ihnen erlauben, sich vom Primärtumor abzusetzen, die Basalmembran und extrazelluläre Matrix zu passieren und in das Blutgefäßsystem einzudringen. Hierzu sind sie genötigt, ihre eigenen oder fremde Adhäsionsmoleküle zu modifizieren (Verlust von Zell-adhäsionsmolekülen wie Integrine, Cadherine (E-Cadherin), IgSF (CD2, CD4, CD8, CAM, VCAM, NCAM, CCAM) und Selektine) und müssen zur Migration fähig sein. Wenn der metastatische Zellverband Immunreaktionen überdauert, dann erfolgt die Anhaftung an Endothelzellen, um mit der Extravasation in das sekundäre Organgewebe zu gelangen.
Metastatische Kaskade: nach einem initialen transformierenden Ereignis folgen weitere Schritte bis der Metastasen in einem sekundärem Organ (siehe Abbildung 1).
Das Gehirn als Zielorgan einer Metastasierung unterscheidet sich von anderen Organen. Es ist durch die Blut-Hirnschranke – eine anatomische und funktionelle Barriere – geschützt, die aus Endothelzellen, Basalmembran, Perizyten und Astrozytenfortsätzen besteht.
Klinik
Klinisch manifestieren sich zerebrale Metastasen durch Kopfschmerzen (50 Prozent), fokale neurologische Defizite (z.B. Hemiparese) (50 Prozent), Krampfanfälle (15 bis 20 Prozent), hirnorganisches Psychosyndrom (Apathie, Verwirrtheit, Orientierungsstörung) oder kognitive Defizite (30 Prozent) und durch eine Hirndrucksymptomatik (10 Prozent). Die Krankheitszeichen entstehen selten akut oder apoplektiform (z. B. Tumoreinblutung, Okklusivhydrozephalus), sondern meist progredient.
Bildgebende Diagnostik
Die Magnetresonanztomographie (MRT: T1 und T2-Wichtung) ist die Methode der Wahl zum Nachweis von intrazerebralen Metastasen > 3 Millimeter oder eines meningealen Befalls (Meningeosis carcinomatosa). Hirnmetastasen stellen sich in der Bildgebung als scharf begrenzte, solide, polyzyklische oder zystische Raumforderungen mit zentraler Nekrose dar, die stark Kontrastmittel aufnehmen. Das peritumorale Ödem ist hypodens bzw. hypointens. Steht ein MRT nicht zur Verfügung oder ist dies kontraindiziert (z. B. beim Herzschrittmacher, Nervenstimulationsgerät, Cochleaimplantat), sollte eine Computertomographie (CT) mit Kontrastmittel veranlasst werden. Diagnostische Unsicherheiten können in der CT-Diagnostik bei knochennahen Prozessen, kleinen Metas¬tasen oder infratentoriellen Raumforderungen auftreten.
Stehen differentialdiagnostische Überlegungen hinsichtlich Metastasenprogression oder Strahlennekrose an, kann die Durchführung eines FDG-PET (Fluorodeoxyglukose-Positronenemissionstomographie), Aminosäure-PET oder eine MRT-Spektroskopie wertvoll sein.
Therapie
Zur Therapie von Hirnmetastasen stehen heute fünf verschiedene Verfahren zur Verfügung:
- Operation
- Radiochirurgie (Gamma knife, stereotaktische Radiotherapie)
- Radiotherapie (Whole Brain Radiation Therapy [WBRT])
- Chemotherapie
- Supportive Maßnahmen (Kortison, Antikonvulsiva)
Bei den meisten Patienten kommt eine Kombination dieser Therapien in Betracht mit dem Ziel einer längeren lokalen Tumorkontrolle sowie einer Verbesserung der Überlebenszeit und der Lebensqualität.
Die Chemotherapie ist bei der Behandlung von Hirnmetastasen vielfach von untergeordneter Bedeutung (insbesondere beim Nierenzell-Ca, gastrointestinalen Tumoren, dem malignen Melanom), da die Hirnmetastasen wegen der Blut-Hirnschranke chemotherapieresistent sind (Ausnahme: Keimzelltumoren).
Eine supportive Therapie erfolgt bei fortgeschrittener Tumorerkrankung und besteht in der Gabe von Steroiden, meist Dexamethason und Antikonvulsiva wie Levetiracetam (Keppra®), Lamotrigin (Lamictal®) und Gabapentin (Neurontin®) bei den Patienten, die mit einem Krampfanfall symptomatisch wurden. Eine prophylaktische Gabe von Antikonvulsiva ist nicht indiziert.
Indikation für den neurochirurgischen Eingriff
Die Operation hat inzwischen einen hohen Stellenwert in der Therapie von Hirnmetastasen, dies gilt insbesondere bei symptomatischen oder raumfordernden Metastasen. Randomisierte Studien belegen, dass die Resektion singulärer oder solitärer Metastasen, gefolgt von einer WBRT, der alleinigen WBRT signifikant überlegen ist.
Bei folgenden klinischen Konstellationen, die prognostisch entscheidend sind, wird eine Operation empfohlen:
- Singuläre oder solitäre Metastase
- Guter Allgemeinzustand (Karnofsky > 70)
- Alter < 65 Jahre
- Fehlen extrakranieller Tumormanifestationen oder „stable disease“
- Operativ gut zugängliche Lokalisation der Raumforderung
- Geringes Risiko schwerer neurologischer Defizite post OP
- Langes krankheitsfreies Intervall seit Diagnose des Primarius
- Histologie (günstig Mamma-Ca, Keimzelltumoren)
- Keine leptomeningeale Beteiligung
Eine Indikation zur Operation besteht ferner bei vitaler Gefährdung durch den raumfordernden Effekt einer Metastase oder bei unbekanntem Primarius zur histologischen Diagnosesicherung.
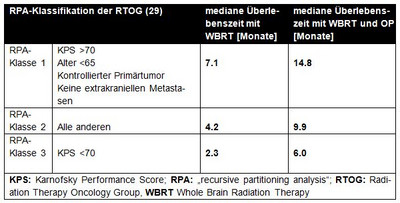
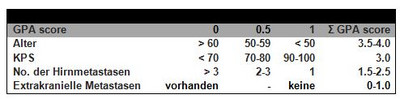
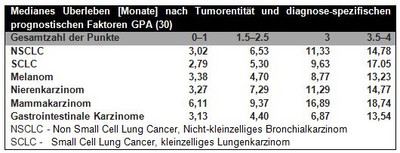
Ein wichtiges Instrument zur Abschätzung der Erfolgsaussichten bei der operativen Behandlung von Hirnmetasen bietet die RPA (recursive partitioning analysis)-Einteilung der RTOG und das „graded prognostic assessment (GPA= diagnose-spezifische prognostische Faktoren)“. Letztere erlaubt eine präzise prognostische Einschätzung des mittleren Überlebens in Abhängigkeit von der Anzahl der Hirnmetastasen, Histologie, KPS und Alter der Patienten (siehe Abbildung 2, 3, 4).
Anforderung und Besonderheiten der neurochirurgischen Therapie
Die operative Entfernung einer Hirnmetastase stellt heute, auch aufgrund des zur Verfügung stehenden Equipments (u. a. Mikroskop, Neuronavigation, Ultraschallzertrümmerungsgerät, intraoperatives Neuromonitoring, Imagefusion, intraoperativer Ultraschall), in der Regel keine Schwierigkeit dar. Zumal wenn folgende Anforderungen an die neurochirurgische Therapie erfüllt werden: minimal invasiv, äußerst schonende mikrochirurgische Resektion, einzeitige Exstirpation, unter Umständen auch multipler Metastasen.
Die Exposition und der Zugang werden auf das Notwendigste minimiert, um eine möglichst kleine Wundfläche zu hinterlassen. Die Exstirpation der Metastase wird mit dem Operationsmikroskop und unter Verwendung der Neuronavigation durchgeführt. Dabei unterscheidet sich das technische Konzept der offenen neurochirurgischen Metastasenentfernung von der extrazerebralen Tumorchirurgie bezüglich der eingeschränkten Radikalität und der Schwierigkeit einer En-bloc Resektion. Wird in der extrazerebralen Chirurgie die Eröffnung des Tumors zur Meidung einer Sekundärdissemination vermieden, so ist dies erfahrungsgemäß oft nicht möglich, eine Metastase in toto aus dem Hirngewebe herauszulösen oder diese unter Mitnahme einer potentiell infiltrierten peritumoralen Gliaschicht zu resezieren, ohne dass schwerwiegende postoperative neurologische Defizite auftreten. Die stückweise Resektion der Metastase in piece-meal Technik hat gegenüber der en bloc Entfernung den Nachteil, dass ein signifikant höheres Risikos besteht, dass sich ein Lokalrezidiv bildet. Daher wird eine postoperative Nachbestrahlung in jedem Fall empfohlen.
Therapie von multiplen Hirnmetastasen
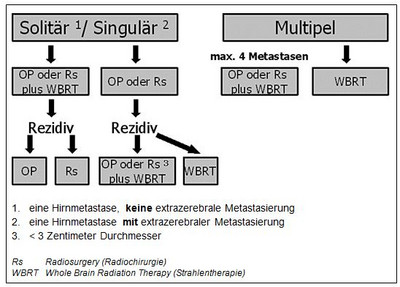
Bei Patienten mit multiplen Metastasen ist eine adäquate Therapieempfehlung schwierig und beschränkte sich bis vor wenigen Jahren auf die alleinige WBRT. Durch die Neuronavigation ist es heutzutage durchaus möglich, einzeitig (in einem Eingriff) drei bis maximal vier Metastasen zu exstirpieren. Voraussetzungen für die operative Behandlung sind ein guter Allgemeinzustand des Patienten und eine stabile extrazerebrale Metastasierung (siehe Abbildung 5). Zudem sollten die Raumforderungen chirurgisch entfernt werden, die gut erreichbar sind und eine Größe von mehr als 3 Zentimeter Durchmesser aufweisen.
Metastasen mit einem Durchmesser von weniger als 3 Zentimetern in den Stammganglien oder Hirnstamm erfordern eine radiochirurgische (Gamma Knife oder Linearbeschleuniger) Therapie (siehe Abbildung 6).
Behandlung des Metastasenrezidivs
Die chirurgische Behandlung zerebraler Metastasenrezidive wird individualisiert geplant und berücksichtigt den Allgemeinzustand des Patienten sowie die bereits erfolgte Primärtherapie. An einem selektionierten Krankengut konnte nach einer Rezidivoperation eine mediane Überlebenszeit von nochmals 11,5 Monaten erzielt werden. Eine erneute Resektion kann bei strahlenresistenten Tumoren (gastrointestinale Metastasen, Melanome, Nierenzellkarzinome), bei metachronen (= zu verschiedenen Zeiten auftretend) solitären Metastasen (insbesondere, wenn das Intervall zwischen Ersteingriff und Rezidiv > 4 Monate) oder bei beherrschbarer Grunderkrankung erwogen werden. Erfolgte zuvor keine WBRT, so sollte diese in Betracht gezogen werden. Bei wenigen umschriebenen Läsionen, nach bereits erfolgter WBRT oder bei Strahlenresistenz, kann sekundär eine radiochirurgische Maßnahme erfolgen.
Autorin:
Prof. Dr. med. R. Verheggen,
Abteilung Neurochirurgie - AGAPLESION EV.BATHILDISKRANKENHAUS, BAD PYRMONT